Sulfenové kyseliny
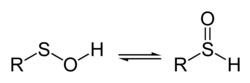
Sulfenové kyseliny jsou organosirné sloučeniny odpovídající vzorci R-S-OH. Jsou první úrovní řady organosirných oxokyselin, kam patří též sulfinové kyseliny (R−S(=O)OH) a sulfonové kyseliny (R−S(=O)2OH). Základní sloučeninou této řady, pro R = H, je thioperoxid vodíku.
Vlastnosti
Oproti sulfinovým a sulfonovým jsou jednoduché sulfenové kyseliny, například kyselina methansulfenová, CH3SOH, vysoce reaktivní a nelze je izolovat v roztocích; v plynném skupenství je poločas rozkladu kyseliny methansulfenové okolo jedné minuty. Plynná kyselina methansulfenová má, jak bylo zjištěno mikrovlnnou spektroskopií, strukturu CH3–S–O–H.[1]
Sulfenové kyseliny mohou být stabilizovány sterickými efekty, které brání jejich autokondenzacím za tvorby thiosulfinátů, RS(O)SR. Struktura těchto stabilizovaných sulfenových kyselin odpovídá vzorci R–S–O–H.[2][3]
Stabilní kyselina triptycen-1-sulfenová má pKa 12,5 a disociační energie vazby O–H je 301 ± 1 kJ/mol; u (valenčně) isoelektronického hydroperoxidu (ROOH) je pKa větší než 14 a disociační energie vazby O–H činí přibližně 370 kJ/mol.[4]
Vznik a výskyt
Peroxiredoxiny
Peroxiredoxiny jsou enzymy, které detoxikují peroxidy; přeměňují přitom cysteinové zbytky na sulfenové kyseliny, které se poté reakcemi s dalšími cysteiny mění na disulfidy.[5]
Česnek a cibule
Sulfenové kyseliny se také vytváří při enzymatickém rozkladu aliinu a podobných sloučenin po poškození buněk česneku a cibule. Kyselina propen-1-sulfenová, vznikající při krájení cibule, se rychle přeměňuje na syn-propanthial-S-oxid.[6]
Kyselina propen-2-sulfenová, vzniklá z alicinu, je pravděpodobným původcem antioxidačních vlastností česneku.[7]
Pomocí hmotnostní spektrometrie bylo zjištěno, že poločas rozkladu kyseliny 2-propensulfenové je kratší než 1 sekunda.[8]
Farmakologická aktivita některých léčiv, jako jsou omeprazol, esomeprazol, tiklopidin, klopidogrel, a prasugrel se připisuje tvorbě sulfenových kyselin jako meziproduktů jejich metabolismu.[9]
Oxidace cysteinových zbytků v bílkovinách, vytvářející příslušné sulfenové kyseliny, jsou důležité pro redoxně řízené signální transdukce.[10][11]
Sulfenenové kyseliny jsou jedněmi z produktů reakcí probíhajících při rozkrojení cibule. Slzné žlázy jsou drážděny konečným produktem těchto reakcí, syn-propanthial-S-oxidem.[12]
Chemické vlastnosti

Sulfoxidy mohou po zahřátí procházet Ei eliminacemi za vzniku vinylalkenů a sulfenových kyselin:[13][14]
Sloučeniny vstupující do takovýchto reakcí se používají jako stabilizátory polymerů, kde brání jejich poškozování dlouhodobým působením vyšších teplot;[15] nejčastěji se používají thiodipropionátové estery.[16]
Sulfenátové ligandy lze nalézt na aktivních místech nitrilhydratáz. Skupina S=O slouží jako nukleofil, který atakuje nitril.[17]
Další sulfenylové sloučeniny

Skupina RS (R ≠ H) se označuje názvoslovnou předponou sulfenyl; příkladem sloučeniny může být methansulfenylchlorid, CH3SCl.[18]
Sulfenátové estery, RSOR, vznikají reakcemi sulfenylchloridů s alkoholy.[19]
Sulfenátové estery jsou meziprodukty Mislowových-Evansových přesmyků allylsulfoxidů.[13] Jsou také popsány sulfenamidy, RSNR′2.
Reference
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace monografie
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace elektronické monografie
- ↑ 13,0 13,1 Braverman, S., Rearrangements involving sulfenic acids and their derivatives, Sulfenic Acids and Derivatives, 1990, John Wiley & Sons Šablona:Doi
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace monografie
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace monografie
- ↑ Šablona:Citace periodika