Diamantan
Šablona:Infobox - chemická sloučenina Diamantan je organická sloučenina patřící mezi diamantoidy, uhlovodíky s klecovitou strukturou podobnou jednotkové buňce diamantu. Tuto bezbarvou až bílou pevnou látku lze izolovat z ropy a zemního plynu. Diamantoidy se vyznačují neobvyklými vlastnostmi, jako jsou nízké povrchové napětí, vysoká hustota, hydrofobicita, a odolnost vůči oxidaci.[1]
Výskyt a historie
Diamantan se přirozeně vyskytuje v surové ropě; předpokládá se, že adamantany a diamantany se zde vytváří katalytickými přesmyky polycyklických naftenů. Přestože se obvykle vyskytují jen ve stopových množstvích, tak se díky termodynamické stabilitě koncentrují, takže se stávají významnými složkami některých kondenzátů zemního plynu.[2]
V roce 1966 byl diamantan izolován z vysokovroucích frakcí hodonínské ropy (kde byl také objeven adamantan) a také se podařilo zlepšit účinnost jeho umělé přípravy, na 10 %., Přestože bylo stále obtížné jej získat ve větších množstvích, tak se diamantan stal podobně dostupným jako adamantan a jeho výzkum byl usnadněn.[3]
Příprava a výroba
Diamantan lze připravit přesmyky pentacyklických tetradekanů, katalyzovanými Lewisovými kyselinami; nejlepší výtěžnost (84 %) poskytuje trans-tetrahydro-binor-S Další možností je přesmyk hydrogenované sloučeniny binoru-S, při kterém výtěžnost činí kolem 70 %. Jiné prekurzory, se silnějšími sterickými efekty, vytváří diamantan s menšími výtěžky (1–47 %), jelikož se disproporcionují.[3]
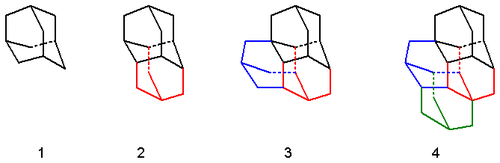
Průmyslová výroba začíná dimerizací norbornadienu (1), katalyzovanou směsí bromidu kobaltnatého, trifenylfosfinu, a etherátu fluoridu boritého. Vzniklý dimer (2) se hydrogenuje na izomery tetrahydro-binor- (3a–3d), kde sterické interakce způsobují převažující tvorbu izomerů 3a a 3b. Dalším krokem je přesmyk, prováděný v horkém cyklohexanu nebo sulfidu uhličitém za přítomnosti bromidu hlinitého, jehož hlavním produktem je diamantan (4).[4][5][6]

Diamantan lze také získat tepelným štěpením alkanů s dlouhými řetězci; předpokládá se, že peroces probíhá skrz radikálovou adici. I když takto vzniká alkylovaný diamantan, tak se tvoří i větší množství derivátů adamantanu, protože jsou termodynamicky stálejší. Při tomto postupu se vytváří i homologická řada n-alkanů s až 35 atomy uhlíku, a také koks.[7]
Vlastnosti
Diamantan patří do skupiny sloučenin známých jako diamantoidy. Jejich struktura se skládá z buněk o diamantovité struktuře:

Vzhledem ke své struktuře má diamantan oproti jiným uhlovodíkům vysokou teplotu tání a je také chemicky i tepelně stálejší.
| Slučovací entalpie | Zdroj |
|---|---|
| [8] | |
| [8] |
Reakce
Diamantan lze nitrovat působením tetrafluorboritanu nitronia v nitromethanu neobsahujícím nitrily za vzniku směsi dvou izomerních nitrodiamantanů.[9]
Chlorací chloridem hlinitým a acetylchloridem vznikají 1- a 4-chlordiamantan ve stejných množstvích, zatímco při použití kyseliny chlorsírové převažuje mezi produkty 1-chlorovaný izomer. Hydrolýzou takto vzniklých chloridů se tvoří alkoholy, které lze oddělit sloupcovou chromatografií.[10]
Reference
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ 3,0 3,1 Šablona:Citace periodika
- ↑ Gund, T. M.; Osawa, E.; Van Zandt, W.; Schleyer, P. v. R.: Diamantane. 1. Preparation of Diamantane. Physical and Spectral Properties, Journal of Organic Chemistry, Band 39, Nr. 20, 1974, S. 2979–2987, doi:10.1021/jo00934a009
- ↑ Gund, T. M.; Osawa, E.; Van Zandt, W.; Schleyer, P. v. R.: A Convenient, High-Yield Preparation of Diamantane (Congressane), Tetrahedron Letters, 1970, Band 11 , Nr. 44, S. 3877–3880, doi:10.1016/S0040-4039(01)98613-7
- ↑ Gund, T. M.; Thielecke, W.; Schleyer, P. v. R.: Diamantane: PENTACYCLO[7.3.1.14,12.02,7.06,11]TETRADECANE[Butanetetraylnaphthalene, 3,5,1,7-[1,2,3,4]-decahydro-], Organic Syntheses, Band 53, 1973, S. 30, doi:10.15227/orgsyn.053.0030
- ↑ Šablona:Citace periodika
- ↑ 8,0 8,1 Clark,T.; Knox, T. M.; McKervey, M. A.; Mackle, H.; Rooney, J. J.:Thermochemistry of bridged-ring substances. Enthalpies of formation of some diamondoid hydrocarbons and of perhydroquinacene. Comparisons with data from empirical force field calculations, Journal of the American Chemical Society, Band 101, Nr. 9, 1979, S. 2404–2410, doi:10.1021/ja00503a028
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika