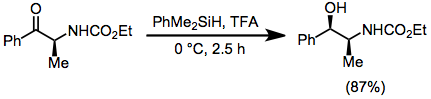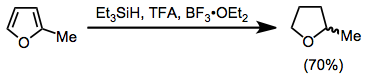Redukce pomocí hydrosilanů
Redukce pomocí hydrosilanů jsou reakce používané na hydrogenace a hydrogenolýzy organických sloučenin, patřící mezi iontové hydrogenace. Substrát zde reaguje s hydrosilanem a další sloučeninou, často se silnou kyselinou, což vede k přenosu hydridového iontu z křemíku na uhlík.[1]
Možnosti
Deoxygenace alkoholů a organohalogenidů
Některé alkoholy lze redukovat na alkany reakcemi s hydrosilany za přítomnosti silných Lewisových nebo Brønstedových kyselin. V redukcích terciárních alkoholů je obvykle redukčním činidlem etherát fluoridu boritého.[2] Primární alkoholy vyžadují nadbytek silanu, silnější Lewisovy kyseliny a delší reakční doby.[3]
Někdy dochází k přesmykům.[4] Dalšími vedlejšími reakcemi jsou nukleofilní ataky konjugovaných zásad na karbokationtových meziproduktech.[5]
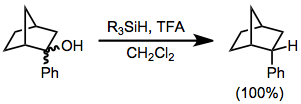
Organosilanové redukce substrátů s prostereogenními skupinami mívají často vysokou diastereoselektivitu. Redukcí kteréhokoliv diastereomeru 2-fenyl-norbornan-2-olu vzniká pouze endo diastereomer 2-fenylnorbornanu,[6] tvorba exo diastereomeru nebyla pozorována.
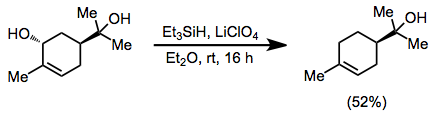
Allylalkoholy mohou být deoxygenovány za přítomnosti terciárních alkoholů, s použitím etherového roztoku chloristanu lithného, sloužícího jako zdroj Li+.[7]
Redukce alkylhalogenidů a alkyltriflátů mají obecně nižší výtěžky než redukce alkoholů; je při nich nutná Lewisova nebo Bronstedova kyselina.[8]
Redukce karbonylových sloučenin
Aldehydy a ketony
Polymerní hydrosilany, jako je polymethylhydrosiloxan (PHMS), mohou usnadňovat oddělování redukovaných produktů od křemíkatých vedlejších produktů.[9][10]
Enantioselektivní redukce ketonů lze provést s použitím katalytických množství chirálních komplexů přechodných kovů.[11]
V některých případech má přechodný kov úlohu Lewisovy kyseliny, která se koordinuje na kyslíkový atom ketonu; některé kovy (obzvláště měď) reagují s hydrosilany za tvorby hydridových meziproduktů, které jsou poté aktivními redukčními činidly.[12]
Fenylcyklohexanon se redukuje za přítomnosti rhodiového katalyzátoru 1 a chloridu rhoditého, přičemž reakce není diastereoselektivní, ale má vysokou enantioselektivitu.[13]
Estery
Estery lze lze zredukovat na alkoholy po nukleofilní aktivaci fluoridem cesným nebo draselným.[14]
Aldehydy se za přítomnosti hydrosilanů a fluoridů hydrosilylují; vzniklé silylethery lze hydrolyzovat 1molární kyselinou chlorovodíkovou. Nejvyšší výtěžnosti se dosahují ve vysoce polárních rozpouštědlech.[10]
Redukce vazeb C=C
Hydrosilany mohou redukovat 1,1-disubstituované vazby, které vytvářejí protonací stabilní terciární karbokationty. Trisubstituované dvojné vazby lze redukovat selektivně, pokud jsou přítomny 1,2-disubstituované a nebo monosubstituované alkeny.[15]
Aromatické sloučeniny mohou být redukovány kyselinou trifluoroctovou a triethylsilanem. Substituované furany se redukují na tetrahydrofurany za vysokých výtěžků.[16]
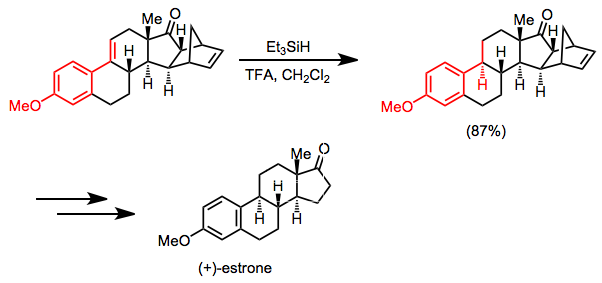
Při přípravě (+)-estronu se jako hlavní krok používá selektivní hydrosilanová redukce konjugovaného alkenu. Karbonylová skupina ketonu a izolované dvojné vazby zůstávají nezměněny.[17]
Štěpení etherů
Acetaly, ketaly a aminaly se také dají redukovat hydrosilany s kyselinami. Regioselektivní redukce acetalu s neekvivalentními kyslíky byla například zahrnuta do syntézy oseltamiviru (Tamiflu).[18]
K funkčním skupinám redukovatelným pomocí hydrosilanů patří rovněž amidy,[19] α,β-nenasycené estery[20] enaminy,[21] iminy[22] a azidy.[23]
Bezpečnost
Kyselina trifluoroctová, často používaná v těchto redukcích, je silnou kyselinou a patří mezi žíraviny. Některé hydrosilany jsou samozápalné.
Reference
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ 10,0 10,1 Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Bolestova, G. I.; Parnes, Z. N.; Kursanov, D. N. J. Org. Chem. USSR (Engl. Transl.) 1979, 15, 1129.
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika
- ↑ Šablona:Citace periodika